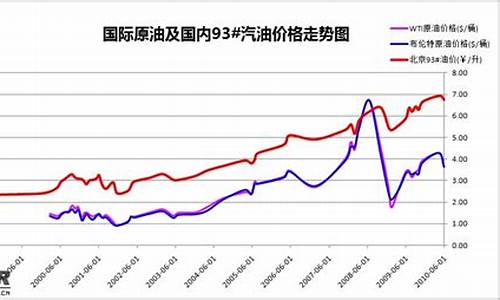
易熔合金属于_环保易溶合金价格
1.普通黄铜中为什么含有铅
2.随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”.为回收利用含
3.随着材料科学的发展,金属钒被誉为“合金的维生素”.为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残
4.铅合金为什么在空气中不生锈
5.随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”.为了回收利用
6.镀锡铜提铅锡合金不伤铜?
普通黄铜中为什么含有铅

在学术上规定的普通黄铜中并没有铅,但是在生活中常用的黄铜并不是普通黄铜,而是特殊黄铜。黄铜是由铜和锌所组成的合金。根据黄铜中所含合金元素种类的不同,黄铜分为普通黄铜和特殊黄铜两种。如果只是由铜、锌组成的黄铜就叫作普通黄铜,如果是由二种以上的元素组成的多种合金就称为特殊黄铜,如由铅、锡、锰、镍、铅、铁、硅组成的铜合金。因为铅不固溶于铜,在铜合金中固溶度也很小,与铜形成易溶共晶组织。固态下,铅在铜中以单质状态分布,可以分布在晶内和晶介,含铅的铜合金,在发生相变或再结晶时,晶介的铅可以转移到晶内;铅对铜及合金导电和导热性能无显著影响,但可以改善切削性能,铅质点又是固相,正是轴承材料所希望的,所以含铅铜及合金是宝贵的易切削材料与轴承材料,因其成本低廉更为市场所欢迎,含铅黄铜使用极为广泛。含铅铜合金对原料的适应性极强,可以直接使用再生铜生产含铅铜合金,这对铜加工企业非常重要。
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”.为回收利用含
(1)钒核外电子排布式为1s22s22p63s23p63d34s2,处于d区,故钒处于第四周期第ⅤB族;铝与五氧化二钒反应生成钒与氧化铝,反应方程式为3V2O5+10Al?
| ||
| ? |
故答案为:四;VB;3V2O5+10Al?
| ||
| ? |
(2)加入硫酸和亚硫酸钠,目的是利用氧化还原反应,用亚硫酸钠还原V2O5,将V2O5?转化为可溶性的VOSO4,便于提纯,
故答案为:将V2O5?转化为可溶性的VOSO4;
(3)根据NH4VO3难溶于水,利用复分解反应沉淀VO3-,离子方程式为:NH4++VO3-=NH4VO3↓,
故答案为:NH4++VO3-=NH4VO3↓;
(4)测定反应②溶液中钒的含量,可用已知浓度的酸化H2C2O4溶液滴定(VO2)2SO4溶液,主要产物为CO2和VOSO4,根据化合价升降,写出的离子方程为2VO2++H2C2O4+2H+=2?VO2++2?CO2↑+2?H2O,
故答案为:2;1;2;2;2;2H2O;
(5)根据NH4VO3在焙烧变化的图象可知:
2NH4VO3═V2O5+2NH3↑+H2O
234g?34g18g
减少值开始为0~17g,曲线到200℃时(约为16.0g)曲线开始平直;到约为300℃时又开始减少(H2O的质量),到350℃时减少24g时就不再变化,所以NH4VO3在焙烧过程中200℃时左右先失去氨;在300~350℃再失去水,
故答案为:B.
随着材料科学的发展,金属钒被誉为“合金的维生素”.为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残
(1)铝和五氧化二钒发生铝热反应的方程式为:3V2O5+10Al?
| ||
| ? |
| ||
| ? |
(2)根据溶解性表知,滤渣是V2O5,酸性条件下,V2O5和亚硫酸钠发生氧化还原反应生成VOSO4,离子反应方程式为:V2O5+SO32-+4H+═2VO2++SO42-+2H2O,
故答案为:V2O5+SO32-+4H+═2VO2++SO42-+2H2O;
(3)2VOSO4→(VO2)2SO4,每生成1mol(VO2)2SO4转移2NA个电子,故答案为:2NA;
(4)K=
| c(VO3?) |
| c2(OH?).c(VO2+) |
| c(VO3?) |
| c2(OH?).c(VO2+) |
(5)分离不溶性固体和液体用过滤的方法,过滤过程中需要的玻璃仪器有:玻璃棒、漏斗、烧杯,为防止有可溶性的杂质要进行洗涤沉淀,
故答案为:玻璃棒,漏斗,烧杯;沉淀洗涤.
铅合金为什么在空气中不生锈
1.Pb(NO3)2+2HCl=PbCl2↓+2HNO3↑ 2.铅的不溶盐有PbCrO4(**),PbCl2(难溶于冷水),PbSO4等等。 3.醋酸铅是弱电解质 4 2PbO2 + 2H2SO4 = 2PbSO4 + O2 + 2H2O PbO2本身加热分解也放出O2,当它与可燃物如P、S在一起研磨时即发火,所以用于制造火柴中。 铅是金属,既能生成铅酸盐,又能与盐酸、硫酸作用生成 Pbcl2和PbSO4的表面膜。因其膜几乎不再溶解,而能起到阻止继续被腐蚀的钝化作用。 铅 化学符号是Pb 原子序数为82。铅是一种软的重金属,它有毒性,是一种有延伸性的弱金属。铅的本色是青白色的,在空气中它的表面很快被一层暗灰色的氧化物覆盖。铅被用作建筑材料,用在铅酸蓄电池中,用作枪弹和炮弹,焊锡、奖杯和一些合金中也含铅。铅是所有稳定的化学元素中原子序数最高的。 铅是金属元素,它的主要氧化数为+2和+4。 (1)室温下,铅即与空气中的氧、水和二氧化碳作用,表面生成一层致密的碱式碳酸铅的保护膜而失去金属光泽。 4Pb+2O2+2CO2+2H2O === 2PbCO3.Pb(OH)2↓ (2)加热时,铅能与氧、硫、卤素等非金属直接反应生成氧化物、硫化物和卤化物。 2Pb+O2== 2PbO Pb+S== PbS Pb+X2==PbX2 (X=F,Cl,Br,I) (3)在空气存在下,铅能与水缓慢反应生成氢氧化铅: Pb+O2+2H2O === 2Pb(OH)2 (4)铅与酸反应都生成Pb(Ⅱ)化合物。 ①铅与稀盐酸或稀硫酸作用,因生成难溶的PbCl2和PbSO4而使反应终止: Pb+2HCl === PbCl2↓+H2↑ (白色) Pb+H2SO4 === PbSO4↓+H2↑ (白色) ②铅溶于热的浓盐酸或浓硫酸: Pb+3HCl ==H[PbCl3]+H2↑ Pb+3H2SO4 ==Pb(HSO4)2 + SO2↑+2H2O ③铅不与浓硝酸作用,与稀硝酸反应生成可溶的硝酸铅: 3Pb+8HNO3 === 3Pb(NO3)2+2NO↑+4H2O ④在有氧存在的条件下,铅可溶于醋酸,生成易溶的醋酸铅,这就是醋酸从含铅矿石浸取铅的原理: 2Pb+O2+2H2O === 2Pb(OH)2 2Pb(OH)2+2HAc === Pb(Ac)2+2H2O ⑤在强碱溶液中,铅能缓慢溶解,生成亚铅酸盐: Pb+2NaOH === Na2PbO2+H2↑ 或写成 Pb+NaOH+2H2O === Na[Pb(OH)3]+H2↑铅的“资格”够老的了,人们早在几千年前便已认识铅了。我国在殷代末年纣王时便已会炼铅。古代的罗马人喜欢用铅作水管,而古代的荷兰人,则爱用它作屋顶。 铅是银白色的金属(与锡比较,铅略带一点浅蓝色),十分柔软,用指甲便能在它的表面划出痕迹。用铅在纸上一划,会留下一条黑道道。在古代,人们曾用铅作笔。“铅笔”这名字,便是从这儿来的。铅很重,一立方米的铅重达11.3吨,古代欧洲的炼金家们便用旋转迟缓的土星来表示它,写作“h”。铅球那么沉,便是用铅做的。的弹头也常灌有铅,因为如果太轻,在前进时受风力影响会改变方向。铅的熔点也很低,为327℃,放在煤球炉里,也会熔化成铅水。 铅很容易生锈——氧化。铅经常是呈灰色的,就是由于它在空气中,很易被空气中的氧气氧化成灰黑色的氧化铅,使它的银白色的光泽渐渐变得暗淡无光。不过,这层氧化铅形成一层致密的薄膜,防止内部的铅进一步被氧化。也正因为这样,再加上铅的化学性质又比较稳定,因此铅不易被腐蚀。在化工厂里,常用铅来制造管道和反应罐。著名的制造硫酸的铅室法,便是因为在铅制的反应器中进行化学反应而得名的。 金属铅的重要用途是制造蓄电池。据不完全统计,1l年,铅的世界年产量达308.3万吨,其中大部分是用来制造蓄电池。在蓄电池里,一块抉灰黑色的负极都是用金属铅做的。正极上红棕色的粉末,也是铅的化合物—一氧化铅。一个蓄电池,需用几十斤铅。飞机、汽车、拖拉机、坦克,都是用蓄电池作为照明光源。工厂、码头、车站所用的“电瓶车”,这“电瓶”便是蓄电池。广播站也要用许多蓄电池。 金属铅还有一个奇妙的本领——它能很好地阻挡X射线和放射性射线。在医院里,大夫作X射线诊断时,胸前常有一块铅板保护着;在原子能反应堆工作的人员,也常穿着含有铅的大围裙。铅具有较好的导电性,被制成粗大的电缆,输送强大的电流。铅字是人们熟知的,书便是用铅字排版印成的,然而,“铅字”并不完全是铅做的,而使用活字合金浇铸成的。活字合金一般含有5一30%的锡和10一20%的锑,其余则是铅。加了锡,可降低熔点,便于浇铸。加了锑,可使铅字坚硬耐磨,特别是受冷会膨胀,使字迹清晰。 保险丝也是用铅合金做的,在焊锡中也含有铅。 铅的许多化合物,色彩缤纷,常用作颜料,如铬酸铅是**颜料,碘化铅是金色颜料(与硫化锡齐名)。至于碳酸铅,早在古代就被用作白色颜料。考古工作者发掘到的古代壁画或泥俑,其中人脸常是黑色的。经过化学分析和考证,证明这黑色的颜料是铅的化合物——硫化铅。其实,古代涂上去的并不是黑色的硫化铅,而是白色的碳酸铅。只不过由于长期受空气中微量硫化氢或墓中尸体腐烂产生的硫化氢的作用,才逐渐变成了黑色的硫化铅。这件事一方面说明碳酸铅作为白色颜料的历史很悠久,另一方面也说明碳酸铅作白色颜料有很大的缺点——变黑。现在,我国已不大用碳酸铅作白色颜料,而是用白色的二氧化钛——俗称“钛白”。铅的最重要的有机化合物是四乙基铅,常用作汽油的防爆剂。以上是京广华艺水晶小窝为您收集的信息,希望对您有所帮助。
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”.为了回收利用
(1)铝与五氧化二钒反应生成钒与氧化铝,铝与五氧化二钒反应生成钒与氧化铝,反应方程式为3V2O5+10Al 6V+5Al2O3
故答案为:3V2O5+10Al
| ||
| ? |
(2)V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化,则反应的相关方程式为SO2+V2O5=SO3+2VO2;4VO2+O2=2V2O5,
故答案为:5SO2+V2O5=5SO3+2V;
(3)加入硫酸和亚硫酸钠,目的是利用氧化还原反应,用亚硫酸钠还原V2O5,将V2O5 转化为可溶性的VOSO4,便于提纯,
故答案为:将V2O5转化为可溶性的VOSO4;
(4)含VOSO4的滤液1与主要成分是VOSO4滤液2混合后用氯酸钾氧化,使VOSO4氧化成完全电离可溶于水的(VO2)2SO4,氯元素被还原为Cl-,根据化合价的升降写出离子离子方程式.
故答案为:C1O3-+6VO2++3H2O=6VO2++6H++C1-;
(5)根据图1分析坐标系中的表示含义,看图沉矾率最大在pH?2.0~2.5,95℃;
故答案为:A;
(6)根据NH4VO3在焙烧变化的图象可知:
2NH4VO3═V2O5+2NH3↑+H2O
234g? 34g? 18g
减少值开始为0~17g,曲线到200℃时(约为16.0g)曲线开始平直;到约为300℃时又开始减少(H2O的质量),到350℃时减少24g时就不再变化,所以NH4VO3在焙烧过程中200℃时左右先失去氨;在300~350℃再失去水,
故答案为:B
(7)V2O5得电子而作正极,正极上电极反应式为:V2O5+xe-+xLi+=LixV2O5,
故答案为:V2O5+xe-+xLi+=LixV2O5
镀锡铜提铅锡合金不伤铜?
要制作一个小型的电解设备以从铜中提取铅锡合金,并确保不损害铜本身,您需要遵循一定的化学原理和安全措施。请注意,这涉及到化学物质和电气设备,因此必须严格遵守安全规范。以下是一个基本的指南:
设备和材料
1 电源:一个可以控制电流和电压的直流电源。
2 电解槽:耐酸碱的容器,如玻璃或塑料容器。
3 电极:铜电极作为阳极,铅或锡电极作为阴极。
4 电解液:一种适合铜、铅和锡电解的溶液,比如硫酸铜溶液。
5 安全装备:防护眼镜、手套、实验室大衣等。
6 通风设备:确保操作区域良好的通风。
制作过程
1 准备电解槽:将电解液倒入容器中,不要过满。
2 安装电极:将铜电极连接到直流电源的正极,铅或锡电极连接到负极。
3 调整电源:根据所需的反应强度调整电流和电压。对于铅锡合金的电解,通常需要较低的电流和电压。
4 开始电解过程:打开电源,开始电解。铜阳极上的铅和锡将开始溶解,并在铅或锡阴极上沉积。
5 监控反应:定期检查电解过程,确保铜阳极不被侵蚀。
6 安全操作:全程使用防护装备,并确保良好的通风。
注意事项
电源安全:确保电源符合安全标准,避免水和电的直接接触。
化学品处理:处理化学品时要小心,尤其是在处理酸性或有毒物质时。
监控电极反应:注意观察铜电极的状态,确保铜不被侵蚀。
废液处理:电解完成后,正确处理废弃电解液,遵守当地环境保护规定。
总结
制作小型电解设备需要精确控制电解条件,并严格遵循安全准则。如果您不熟悉电化学或相关安全措施,请在专业人士的指导下进行。此外,确保了解和遵守所有当地法律和安全规定。
[免责声明]本文来源于网络,不代表本站立场,如转载内容涉及版权等问题,请联系邮箱:83115484@qq.com,我们会予以删除相关文章,保证您的权利。