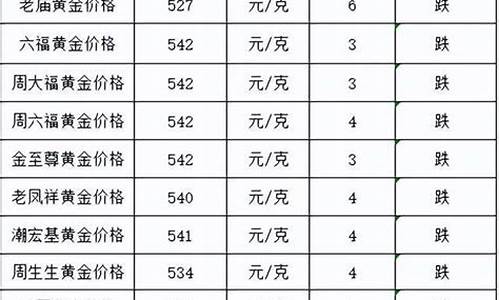
锌合金 价格_淮南锌基合金价格
1.剑是怎样造成的
2.我国有五年前的文明史,有许许多多的发明,举出与化学研究有关的四例
3.西汉时期,我国首开“湿法炼铜”之先河,刘安所著的《淮南万毕术》中已有“曾青得铁化为铜”的记载.回答
4.谁能给我初中化学的各个知识点?
5.有关镀锡技术的配方资料
剑是怎样造成的
仔细看下面的内容,是用窑的。
制作铜剑的基本方法是铸造,铸造一件铜剑大体上有五道工序。
(一)制范 即制作供浇铸用的型范。剑范多用泥塑造,然后放入窑中经火烘干,再加修整,质地似陶,故称泥范或陶范。制范以铜剑的器形设计为依据,而铜剑器形是否能够达到设计要求,规整而谐调、匀称而美观,则决定于制范是否精细。制范还要为以后的装饰打下基础,如剑体上铸出的花纹和名文,都必须预先在剑范的内壁上刻镂出阴阳相反的纹路。实际上,铜剑装饰的第一步是范型上进行的。
(二)调剂 铸剑的材料是青铜,青铜是铜和锡或铜和锡、铅的合金。剂即剂量,指青铜合金中各成分的比例,古时写作“齐”。熔炼青铜之前,须根据合理的配比规律,对铜、锡或铜、锡、铅等原料进行调配,称作调剂。这是决定铜剑性能的关键环节。在一定范围内,青铜中含锡量提高,能够相应提高合金的硬度和强度;但含锡量超过合量的界限,就会使青铜合金变得非常脆弱,易于断折。在青铜合金中加入少量的铅,可调节金属的铸造和加工性能,但铅含量过高,也会降低合金的硬度和强度。因此,只有按照合理的比例对各成分进行调配,才能得到适于充作剑材的既坚且韧的青铜。
对于铜剑合金的成分配比,春秋战国之际已经认识到了其中的规律。《考工记·攻金之工》所记“金有六齐”,标明了六类铜器的成分比例,其中第四类为:大刃即剑;叁分其金而锡居一,指青铜合金作四等分,铜(金)占三分(百分之七十五),锡占一分(百分之二十五)。
近年来,冶金史研究者陆续分析检测了一些春秋晚期和战时期的中原铜剑实,发现其合金成分中,铜的含量与“大刃之齐”很接近,大致在百分之七十五上下;但锡的含量相差较多,实际含量只有百分之十六左右,较高的也只有百分之二十多一些。这种差别可能因为,《考工记》“六齐”只标明了青铜合金中最主要的两种成分——铜和锡,而铜实物中常含有少量铅及其他一些元素(铁、锌等),因之,六齐的铜锡配比法大概是一般性地代表了青铜合金中铜和其他非铜元素的比例,如此,则青铜剑实际成分中其他非铜元素的总量也就大致接近百分之二十五了。
撇开文献和实物的上述差别不管,有两点是明确的。一是《考工记》关于“大刃之齐”的记载说明在春秋战国之际,中原匠师对于铜剑合金万分的配比规律已经有所认识,有所总结,并以之指导铸剑;二是铜百分之七十五上下和锡百分之十六左右的实际合金比例是合理的,一些研究者对如此配比的铜剑作了机械性能和硬度试验,证明其具有很好的强度和硬度。
古人铸剑既无先进的熔炼设备、纯洁的原材料,又无精确的测试手段,匠师们在这种情况下经过长期实践,摸索总结出了青铜合金的配比规律,并具有很强的规律,铸出的铜剑的合金比便也会不尽相同,而呈现在配比常数上下浮动的现象。
(三)熔炼 原料调配停当后,将之装入坩锅炼。熔炼的目的是将铜、锡、铅等原料熔液体,同时也进一步去除原料中含有的杂质,如附着于原料上的木炭,以及原料中含有的氧化物、硫化物和铁等其他金属元素,使合金精纯。
熔炼的关键是观察火候,判断是否熔炼成熟。《考工记》对此有较详记述:
凡铸金之状,金与锡,黑浊之气竭,黄白次之;
黑浊气是原料上附着的木炭、树枝等碳氢化合物燃烧产生的。黄白气主要是熔点低的锡先熔化而产生的,同时,原料中含有的氧化物,、硫化物和其他元素挥发出来也形成不同颜色的烟气;
黄白之气竭,青白次之;
温度升高,铜熔化的青焰色有几分混入,故现青白气;
青白之气竭,青气次之;
温度再高,铜全熔化,铜量大于锡量度,一进只有青气了。而且,焰色纯净,表明原料中的杂质太多气化跑掉了,剩下残渣可予以去除;
然后可铸也。
销炼成熟,可以浇铸了。
上述次序,也是古代匠师长期实践的经验总结,后来人们用“炉火纯青”喻功夫纯熟,就源于这里。
为了提高青铜合金的质量,工匠们还对铜锡进行多次熔炼,以进一步去除杂质。《考工记·栗氏》所记“改煎金锡”,就是指更番,重复煎炼。
(四)浇铸 将熔炼成熟的青铜液体浇灌入剑范,俟其冷却、凝固,铜剑就成形了。
(五)铸后加工 范铸出来的铜剑仅是一个坯件,表面精糙,故卸去铸范后,还须进行如下的修治加工:
——刮削琢磨,使其表面平整光滑;
——装饰,如在铸成的花纹沟槽中镶嵌琉璃、绿松石,或嵌错红铜丝、金丝、银丝,甚至进一步在器表刻镂花纹。嵌错是当时很常见的装饰工艺,它是在铜器表面铸出或刻镂出花纹,再嵌以金、银、铜丝(或片),用错石将表面磨光,即显出色彩鲜明、线条清晰的生动形象;
——装置附件,配齐剑具;
——砥砺开刃。
这样,铜剑的制作就最终完成了。但在使用过程中,剑器还要时常修治砥砺,故当时可能有一类工匠专门从事这项工作。汉代称这类工匠为“削厉(砺)工”,其技艺又称“洒削”之技。削砺就是刮削砥砺的意思;洒削,指磨刀以水洒之,泛指修治刀剑。
西汉景帝时,大臣袁盎被刺,尸体上弃有凶器,是一柄新修治过的剑,官府就在长安的削砺工中访查,一工匠说:这把剑是梁王的某位郎官来修治的。由此便查出了主使人梁孝王。
综上所述,我们可以用战国晚期大学者荀子的一段话来概括铸造铜剑的整个过程:
刑(型)范正,金锡美,工冶巧,火齐(剂)得,剖刑而莫邪已。然而不剥脱,不砥厉,则不可以断绳;剥脱之,砥厉之,则劙盘盂,刎牛马忽然耳。
黄白杂则坚且牣
战国相剑术士曾说:
白所以为坚也,黄所以为牣(韧)也,黄白杂则坚且牣,良剑也。
这种精良之剑也就是我们今天所说的复合剑。战国时期,铜剑应用臻于极盛。在此背景下,铸剑术不断发展进步,出现了一些科学先进的工艺,取得了杰出的成就,其中尤以铸造复合剑的技术最为突出。
所谓复合剑,是指剑脊和剑刃用不同成分配比的青铜合金分别浇铸的青铜剑。其剑脊用含锡量较低的青铜合金,韧性强,不易断折;剑刃用含锡量较高的青铜合金,硬度高,特别锋利。因而刚柔相济,是古代铜剑的精品。其铸造方法也与普通铜剑有别。普通剑之剑身系一次浇铸完毕,复合剑则是二次浇铸:先以专门的剑脊范浇铸剑脊,在剑脊两侧预留出嵌合的沟槽;再把铸成的剑脊置于另一范中浇铸剑刃,剑刃和剑脊相嵌合构成整剑。
从冶金史研究者检测的一些复合剑实物得知,其剑脊的含铜量要高于一般铜剑,含锡量则低于一般铜剑;刃部的情况相反,含铜量低于一般铜剑,含锡量高于一般铜剑。如果单以脊部或刃部的材料制作整剑,势必过于柔软或过于刚脆,但以之分别制作剑脊和剑刃,就获得了超过一般铜剑的更为优秀的性能。这是创造性地运用青铜合金成分配比规律的高超工艺,体现了古代匠师对铜剑合金成分比例的控制达到了极高境界。
复合剑的脊部含铜多,故呈**;刃部含锡多,故泛白色。剑脊和剑刃判然异色,正如相剑术士所言,所以有人称之为“两色剑”。又由于这种剑表面看起来,剑脊像是镶嵌上去的,故也有人称之为“铜镶剑”或“插心剑”,这些都不是科学的名称。
器表之谜
近年来,许多冶金史研究者注意到中原地区出土的一些战国铜剑,表面呈深绿色或灰黑色,虽在地上埋没两千多年,仍光亮而不锈蚀。对这些剑所作检测揭示,其表层硬度要比深层高出许多,而且远远超出普通铜剑的表层硬度。因此学者们推测,这些剑铸成后,可能进行过特殊的表面处理,使器表生成一个复盖层,异常坚硬而不锈蚀,既显著提高性能,又起到防腐蚀的作用。有学者对一些铜剑的检测分析揭示,其表层组织中含铬,是三价铬化物Cr2O3,因此他们认为剑的表面经过了铬化处理。又有学者对另一些铜剑的检测分析揭示,其表面是一层土漆和二氧化硅所形成的高聚物涂层,即生漆漆膜。这方面的研究目前刚开了一个头,要彻底揭开战国铜剑表层组织之谜,还有待于更全面,深入的检测和分析。
见若狐甲而利钝识
《淮南子·氾论训》记:
薛烛庸子,见若狐甲于剑而利钝识矣。
意思是说,齐国薛邑有一位烛庸子,只要见到剑身上指甲盖那么在原一块,就能够鉴别出这把剑是利还是钝。看来,烛庸子精于相剑,并因此而闻名。
所谓相剑,即通过观察器身外表(包括器形、文理、颜色、光泽、铭文、装饰等),来鉴别剑器的优劣和名剑的真伪。战国社会上专门有一类术士以此为务,被称为“相剑者”。《吕氏春秋·疑似》称:“使人大迷惑者,患剑似吴干者。”可见,即使是相剑术士,对于一般铜剑之貌似名剑也很头痛,要予以鉴别,就必须精通铸剑之术,能够识别优劣。故相剑术又以铸剑术为基础。《吕氏春秋·别类》记:“相剑者曰:白所以为坚也,黄所以为牣(韧)也,黄白杂则坚且牣,良剑也。”这句话大概出自相剑术士的相剑经,它就是以铸剑术为依据,结合铜剑的形貌特征和流传使用情况等,即今之所谓掌故,这样才能够最终鉴别名剑的真伪。《吴越春秋》记有薛烛为越王允常相剑的故事,他事先并不知情,仅凭观察,判明了各剑的名称、优劣,并历数其特征、来历和流传始末。这虽是后人编造的传说,但大致反映了相剑的情形。
《韩非子·说林上》也记有一则与相剑有关的故事:
曾从子是一位善相剑之人,客游卫国。卫君怨吴王,曾从子就说:吴王好剑,我是相剑者,请大王让我去为吴王相剑,乘机将他刺死。卫君却说:“你这样做并非缘于义,而是为了利。吴国富强,卫国贫弱,你如果真去了,恐怕反会为吴王用之于我。于是就将曾从子逐走了。
这个故事来看,春秋晚期似已有相剑术。尽管《说林》中的故事都是为游说而编集的事例,有些来源于传说,有些是韩非自己杜撰的,不一定真有其事;但说相剑术大约初起于春秋晚期,却完全有可能,因为古代铜剑正是在这个时期趋于成熟兴盛,并在战争和社会生活中得到了广泛应用。
相剑之所以能够流行而形成为了一门方术,与贵族中盛行的带剑、好剑之风有着密切关系。由于社会上有这么一个显赫阶层,不仅盛行佩剑,而且喜好精良华美的宝剑,于是就出现 了一些以相剑为务的术士,他们出入豪门,专为权贵鉴别刀剑。曾从子、薛烛之流,可谓典型。
我国有五年前的文明史,有许许多多的发明,举出与化学研究有关的四例
一、墨翟
墨翟(公元前479—381),先秦时期墨派思想的创始人,著有《墨经》。在该书中说到:“非半不 昔斤 则不动,说在端。……昔斤 必半,毋与非半,不可昔斤也。……端,是无间也。”意思是说物质到一半的时候,就不能斫开它了。物质如果没有可分的条件,那就不能再分了。墨子的“端”即为物质的最小单位,有现代原子的意义,意味着他对物质非连续性的认识。他的这一认识和古希腊哲学家德漠克利特所提出的原子(不能再分)基本上是同时代的,所以说原子概念的最提出不能抹煞墨子的功劳。
二、刘安
我国西汉时的炼丹家。他著的《淮南万毕术》中记载着“曾青得铁,则化为铜。”意思是说铜遇到铁时,就有铜生成。实质就是我们现在所说的铁和可溶性的铜盐发生的置换反应。这一发现要比西方国家早1700多年。在宋朝时用这一方法炼铜已有相当规模,每年炼铜达5×105kg,占当时铜产量的15%—25%。这种炼铜方法在我国最早,是湿法冶金的先驱。
刘安在他的《淮南子》中写到:“老槐生火,久血为磷。”这句话实质说的是磷的自燃现象。刘安在西汉时能发现这一现象,说明他对磷有所了解。而德国的布朗特是在1660年从尿中发现磷的,他的发现比刘安晚1000年。那么磷的最早发现者应该是刘安。
三、魏伯阳
我国东汉时期炼丹家。生卒年代不详。会稽上虞(今浙江上虞县)人。撰有《周易参同契》,此书是现存世界上最早的一部炼丹术专著。其中化学知识丰富。记载着“丹鼎”这 一化学反应装置,记述了汞易挥发的特性以及汞和硫化合为丹砂(硫化汞)、汞和铅汞齐(汞铅合金)等化学知识。
四、葛洪
我国晋代炼丹家、医学家,自号抱朴子,丹阳句容(江苏句容县)人。著有《抱朴子》一书,所含化学知识丰富。他曾谈到:“丹砂烧之成水银,积变又还成丹砂。”这句话所指的化学反应是:①红色硫化汞(丹砂)在空气中加热生成汞:HgS+O2 ====== Hg + SO2↑②汞和硫在一起研磨生成黑色HgS:Hg + S ====== HgS ③黑色HgS隔绝空气加热(升华)变成红色晶体HgS: HgS HgS
这一事实说明葛洪对化学反应的可逆性初步有所了解,这一了解在当时化学还处于萌芽时期是很了不起的。
五、蔡伦
我国东汉和帝时曾任主管制造御用器物的尚方令。宦官。桂阳人(今湖南来阳县人)。他总结了西汉以来的造纸经验,改用便宜的材料:树皮、碎布、破鱼网为原料,经过精工细作,造出优质纸,被称为“蔡伦纸”。后世人们将蔡伦称为造纸技术的发明人。1000多年来,我国的造纸材料大致都是依照蔡伦的办法加以推广的。
公元751年,唐军与阿拉伯人打仗,唐军败,士兵被俘,俘虏中有造纸工人,将造纸技术传给阿拉伯。然后相继传给了埃及、摩洛哥、西班牙,直到欧洲。
六、陶弘景
我国南北朝(公元5世纪末)时期有名的医学家和炼丹家。他著的《本草经集注》就有焰色反应的记载。书中这样写到:“先时有得一种物,其色理与朴消大同小异,月出月出如握不冰,强烧之,紫青烟起,云是真消石也”。朴消指的是硫酸钠,消石指的是硝酸钾(当时的“消”和“硝”混用)。所以说陶弘景是最早运用焰色反应的人。德国化学家本生是在1854年才发现焰色反应的,比陶弘景的发现晚1000年。
七、马和
我国唐朝的炼丹家,是世界上最早发现氧气的人。马和写的一本书叫做《平龙认》,书中谈到:空气的成分复杂,主要由阳气(N2)和阴气(O2)组成,其中的阳气比阴气多得多……马和还进一步指出:阴气还存在于青石(氧化物)、火硝(硝酸盐)等物质中。如果用火加热它们,阴气就会放出。他认为水中也有大量阴气,不过常难把它取出来。
马和的《平龙认》一直流传清代,后来被德国侵略者乘战乱抢走,我国现无保存。不过,在1807年俄国彼得堡科学院的一次学术讨论会上,德国汉学家朱利斯·克拉普罗兹(Klaproth)宣布了一篇论文,文中说他见过《平龙认》的中文手抄本。近代一些国外专著也提到了马和及《平龙认》。如英国梅勒的《无机化学大全》,苏联湿克拉索夫的《普通化学》教程。湿克拉索夫写到:“在8世纪时,中国学者马和的著作中就明确指出了空气组成的复杂性,提出了制备氧气(阴气)的方法,并发展了燃烧的设。
瑞典化学家舍勒和英国化学家普利斯特里发现氧气是18世纪70年代,比马和的发现要晚1000年。
八、孙思邈
我国唐代医学家。京兆华原(陕西耀县)人。最早记录了黑火药的配方。他写的《丹经内伏硫磺法》载于孟要甫的《诸家神品丹法》第五卷中,对黑火药的配方就有记载。到宋朝时黑火药的生产和应用就很熟练了,火药武器就很先进。公元1225年—1248年由商人将黑火药传入阿拉伯等国家。
九、沈括
北宋仁宗进士,杭州钱塘人。是我国历史上一位卓越的科学家。晚年退居润州(今江苏镇江)梦溪园。写的《梦溪笔谈》一书是世界上科技史上一本重要著作,反映了我国北宋时期自然科学达到的高度。为了纪念他,19年国际上曾以沈括的名字命了一颗新星
沈括在《梦溪笔谈》这本书中最早记载了石油的用途,并预言“此物后必大行于世”。我国古代称石油为“石漆”、唐代叫“石脂水”、五代时叫“猛火油”。沈括第一个提出了“石油”这个科学的命名,后来世界各国也基本上用了“石油”这一名称,沿用至今十、宋应星
我国明代著明的科学家。江西奉新人,出身官僚。一生著作很多,在自然科学方面的代表作是《开工天物》。该书发表的初期轰动全欧洲,在日本兴起“开物之学”。就在科学技术突飞猛进的今天,仍有许多学者对《开工天物》很感兴趣。《开工天物》成为世界科学技术的名著。
《开工天物》中的化学知识是相当丰富的。像该书中叙述的连续鼓风的活塞木风箱比欧洲早100多年。记述的锌的冶炼和铜锌技术是世界上首次文献记载。所以说宋应星是锌元素的发现者。
《开工天物》中有对磷火的记述:“暮夜鬼火游烧……孤野墓坟……直待日黄昏,此火中隙而出……”说明宋应星生前已发现磷的自燃现象。这一发现要比德国的布朗特发现的早。因为布朗特是1669年从尿中发现的,而宋应星已于1661年(历史辞典中)去世。他的《开工天物》在1661年以前早已完成。所以说宋应星发现磷的自燃现象比布朗特发现磷早。
十一、徐寿
我国清末科学家。江苏无锡人。我国近代化学史上一位重要人物。他一生著作很多,在化学方面主要有《化学鉴原补编》、《化学考质》、《化学求数》等书籍。他的著作系统地介绍了19世纪七八十年代化学知识的主要内容。此外他于1875年在上海创立了“格致书院”(格致即格物致知,清末时对物理、化学的总称)公开讲演自然科学知识,还进行化学演示实验,对我国近代化学的发展起了重要的促进作用。
氧气的名称就是徐寿命名的。他认为人的生存离不开氧气,所以就命名为“养气”即“养气之质”,后来为了统一就用“氧”代替了“养”字,便叫这“氧气”。
十二、侯德榜
侯德榜(1890—14),福建闽侯人。早年留学美国。1920年获哥伦比亚大学研究院化学工程博士学位。1921年回国。为我国的制碱工业做出了卓越的贡献。是世界著名的制碱专家。他与范旭东创办了我国第一家民族制碱企业。1925年国产“红三角”牌纯碱在美国费城博览会上荣获金质奖章。他写的《制碱》一书1932年在美国出版,这是世界上第一部有关纯碱工业生产的专著。
1939年侯德榜首先提出联合制碱的连续工程,在世界上被称为“侯氏制碱法”,该法的特点是将制碱厂、合成氨厂、石灰厂联合了起来,降低了成本,提高了利用率,制碱的同时生产化肥(NH4Cl)。这是世界制碱工艺上的重大突破,对制碱和化肥工业做出了杰出贡献。
西汉时期,我国首开“湿法炼铜”之先河,刘安所著的《淮南万毕术》中已有“曾青得铁化为铜”的记载.回答
(1)青铜中含有铜和锌,是常见的合金,属于混合物.故填:混合物;
(2)铁和硫酸铜反应产生硫酸亚铁和铜,反应的化学方程式为:Fe+CuSO4=Cu+FeSO4;该反应的反应物是一种单质和一种化合物,生成物是一种单质和一种化合物,属于置换反应.故填:故答案为:Fe+CuSO4=Cu+FeSO4;置换.
谁能给我初中化学的各个知识点?
初中化学总结
1、化学是一门研究物质的组成、结构、性质以及变化规律的以实验为基础自然科学。物理和化学的共同点:都是以实验为基础的自然科学.
2、化学变化和物理变化的根本区别是:有没有新物质的生成。化学变化中伴随发生一些如放热、发光、变色、放出气体、生成沉淀等现象。
3、物理性质——状态、气味、熔点、沸点、硬度、密度、延展性、溶解性、挥发性、导电性、吸附性等。
4、化学性质——氧化性、还原性、金属活动性、活泼性、稳定性、腐蚀性、毒性等。
5、绿色粉末碱式碳酸铜加热后,①绿色粉末变成黑色,②管口出现小水滴,③石灰水变浑浊。 Cu2(OH)2CO3—
6、我国的某些化学工艺像造纸、制火药、烧瓷器,发明很早,对世界文明作出过巨大贡献。
(空气)
1、空气中氧气含量的测定:实验现象:①红磷(不能用木炭、硫磺、铁丝等代替)燃烧时有大量白烟生成,②同时钟罩内水面逐渐上升,冷却后,水面上升约1/5体积。
若测得水面上升小于1/5体积的原因可能是:①红磷不足,氧气没有全部消耗完②装置漏气③没有冷吹绞椅戮痛蚩?杉小?
2、法国化学家拉瓦锡提出了空气主要是由氧气和氮气组成的。舍勒和普利斯特里先后用不同的方法制得了氧气。
3、空气的成分按体积分数计算,大约是氮气为78%、氧气为21%(氮气比氧气约为4∶1)、稀有气体(混合物)为0.94%、二氧化碳为0.03%、其它气体和杂质为0.03%。空气的成分以氮气和氧气为主,属于混合物。
4、排放到大气中的有害物质,大致可分为粉尘和气体两类,气体污染物较多是SO2、CO、NO2,这些气体主要来自矿物燃料的燃烧和工厂的废气。
(水)
1、水在地球上分布很广,江河、湖泊和海洋约占地球表面积的3/4,人体含水约占人体质量的2/3。淡水却不充裕,地面淡水量还不到总水量的1%,而且分布很不均匀。
2、水的污染来自于①工厂生产中的废渣、废水、废气,②生活污水的任意排放,③农业生产中施用的农药、化肥随雨水流入河中。
3、预防和消除对水源的污染,保护和改善水质,需取的措施:①加强对水质的监测,②工业“三废”要经过处理后再排放,③农业上要合理(不是禁止)使用化肥和农药等。
4、电解水实验可证明:水是由氢元素和氧元素组成的;在化学变化中,分子可以分成原子,而原子却不能再分。
5、电解水中正极产生氧气,负极产生氢气,体积比(分子个数比)为1∶2,质量比为8∶1,在实验中常加稀H2SO4和NaOH来增强水的导电性。通的是直流电。
(O2、H2、CO2、CO、C)
1、氧气是无色无味,密度比空气略大,不易溶于水,液氧是淡蓝色的。
氢气是无色无味,密度最小,难溶于水。
二氧化碳是无色无味,密度比空气大,能溶于水。干冰是CO2固体。(碳酸气)
一氧化碳是无色无味,密度比空气略小,难溶于水。
甲烷是无色无味,密度比空气小,极难溶于水。俗名沼气(天然气的主要成分是CH4)
2、金刚石(C)是自然界中最硬的物质,石墨(C)是最软的矿物之一,活性炭、木炭具有强烈的吸附性,焦炭用于冶铁,炭黑加到橡胶里能够增加轮胎的耐磨性。
金刚石和石墨的物理性质有很大差异的原因是:碳原子排列的不同。
CO和CO2的化学性质有很大差异的原因是:分子的构成不同。
生铁和钢主要成分都是铁,但性质不同的原因是:含碳量不同。
3、反应物是固体,需加热,制气体时则用制O2的发生装置。
反应物是固体与液体,不需要加热,制气体时则用制H2的发生装置。
密度比空气大用向上排空气法 难或不溶于水用排水法收集
密度比空气小用向下排空气法
CO2、HCl、NH3只能用向上排空气法 CO、N2、(NO)只能用排水法
4、①实验室制O2的方法是:加热氯酸钾或高锰酸钾(方程式)
KClO3— KMnO4—
工业上制制O2的方法是:分离液态空气(物理变化)
原理:利用N2、 O2的沸点不同,N2先被蒸发,余下的是液氧(贮存在天蓝色钢瓶中)。
②实验室制H2的方法是:常用锌和稀硫酸或稀盐酸
(不能用浓硫酸和硝酸,原因:氧化性太强与金属反应不生成H2而生成H2O)(也不能用镁:反应速度太快了;也不能用铁:反应速度太慢了;也不能用铜,因为不反应)Zn+H2SO4—
Zn+HCl—
工业上制H2的原料:水、水煤气(H2、CO)、天然气(主要成分CH4)
③实验室制CO2的方法是:大理石或石灰石和稀盐酸。不能用浓盐酸(产生的气体不纯含有HCl),不能用稀硫酸(生成的CaSO4微溶于水,覆盖在大理石的表面阻止了反应的进行)。 CaCO3+ HCl— 工业上制CO2的方法是:煅烧石灰石 CaCO3—
5、氧气是一种比较活泼的气体,具有氧化性、助燃性,是一种常用的氧化剂。
①(黑色)C和O2反应的现象是:在氧气中比在空气中更旺,发出白光。
②(**)S和O2反应的现象是:在空气中淡蓝色火焰,在氧气中蓝紫色的火焰,生成刺激性气味的气体SO2。
③(红色或白色)P和O2反应的现象是:冒白烟,生成白色固体P2O5。(用于发令枪)
④(银白色)Mg和O2反应的现象是:放出大量的热,同时发出耀眼的白光,生成一种白色固体氧化镁。(用于照明弹等)
⑤(银白色)Fe和O2反应的现象是:剧烈燃烧,火星四射,生成黑色固体Fe3O4,注意点:预先放入少量水或一层沙,防止生成的熔化物炸裂瓶底。
⑥H2和O2的现象是:发出淡蓝色的火焰。
⑦CO和O2的现象是:发出蓝色的火焰。
⑧CH4和O2的现象是:发出明亮的蓝色火焰。
酒精燃烧 C2H5OH+ O2—
甲醇燃烧 CH3OH+ O2—
6、H2、CO、C具有相似的化学性质:①可燃性②还原性
① 可燃性 H2+ O2— 可燃性气体点燃前一定要检验纯度
CO+ O2— H2的爆炸极限为4——74.2%
C+ O2— (氧气充足) C+ O2— (氧气不足)
②还原性 H2+CuO— 黑色变成红色,同时有水珠出现
C+ CuO— 黑色变成红色,同时产生使石灰水变浑浊的气体
CO+CuO— 黑色粉末变成红色,产生使石灰水变浑浊的气体
7、CO2 ①与水反应: CO2+H2O— (紫色石蕊变红色)
②与碱反应: CO2+Ca(OH)2— (检验CO2的方程式)
③与灼热的碳反应:CO2+C— (吸热反应,既是化合反应又是氧化还原反应,CO2是氧化剂)
①除杂:CO[CO2] 通入石灰水 CO2+Ca(OH)2—
CO2[CO]通过灼热的氧化铜 CO+CuO—
CaO[CaCO3]只能煅烧 CaCO3—
②检验:CaO[CaCO3]加盐酸 CaCO3+ HCl—
③鉴别:H2、CO、CH4可燃性的气体:看燃烧产物
H2、O2、CO2:用燃着的木条
[(H2、CO2),(O2、CO2),(CO、CO2)]用石灰水
8、酒精C2H5OH,又名乙醇,工业酒精中常含有有毒的甲醇CH3OH,
醋酸又名乙酸,CH3COOH,同碳酸一样,能使紫色石蕊变红色。
无水醋酸又称冰醋酸。
当今世界上最重要的三大矿物燃料是:煤、石油、天然气;煤是工业的粮食,石油是工业的血液。其中气体矿物燃料是:天然气,固体矿物燃料是煤,氢气是理想燃料(来源广,放热多,无污染)。
(铁)
1、铁的物理性质:银白色金属光泽,质软,有良好的延性和展性,是电和热的导体。
2、铁生绣实际上是铁、氧气和水等物质相互作用,铁锈的主要成分是氧化铁Fe2O3(红棕色)。全世界每年因生绣损失的钢铁约占世界年产量的1/4。
3、防止铁制品生绣的方法:①保持铁制品表面的洁净和干燥,②在铁制品的表面涂上一层保护膜。具体操作是:①在其表面刷油漆,②在其表面涂油,③金属制品表面镀上其它金属,④通过化学反应使铁制品的表面生成致密的氧化膜。
4、黑色金属:Fe、Mn、Cr(铬) 有色金属:除前三种以外都是,如Cu、Zn、Al
5、合金(混合物):是由一种金属与其它一种或几种金属(或非金属)一起熔合而成的具有金属特性的物质。 铁的合金有:生铁和钢(混合物)
生铁的含碳量在2%—4.3%之间,钢的含碳量在0.03%—2%之间。
生铁分为白口铁、灰口铁和球墨铸铁,球墨铸铁具有很高的机械强度,某些场合可以代替钢。 钢分为碳素钢和合金钢。
6、炼铁的主要设备是高炉,主要原料是铁矿石、焦炭和石灰石。原理:在高温条件下,用还原剂一氧化碳从铁的氧化物中将铁还原出来。(不能:置换)
炼钢设备:转炉、电炉、平炉。 原理:在高温条件下,用氧气或铁的氧化物把生铁中所含的过量的碳和其它杂质转变为气体和炉渣而除去。
7、白口铁的用途:用于炼钢、灰口铁的用途制造化工机械和铸件。
低碳钢和中碳钢用来制造机械零件,钢管。高碳钢用来制刀具、量具和模具。
8、锰钢中合金元素为锰,韧性好,硬度大;不锈钢中合金元素为铬、镍,抗腐蚀性好;硅钢中合金元素为硅,导磁性好;钨钢中合金元素为钨,耐高温,硬度大。
9、导电性:银>铜>铝,铝和锌在空气中能形成一层致密的氧化物薄膜,可阻止进一步氧化。铜生锈是铜和水、氧气、二氧化碳发生的反应。钛耐腐蚀性好。
(溶液)
1、溶液的特征:均一稳定的混合物。
①加水②升温
饱和溶液 不饱和溶液 熟石灰对温度例外
①增加溶质②降温③蒸发溶剂
饱和石灰水变成不饱和的石灰水的方法是:①加水②降温
对于同一种溶质的溶液来说,在同一温度下,饱和溶液一定比不饱和溶液要浓。
2、20℃时,易溶物质的溶解度为>10g,可溶物质的溶解度1g—10g,微溶物质的溶解度为0.01g—1g,难溶物质的溶解度为<0.01g。
3、分离:KCl和MnO2方法为过滤,步骤:溶解、过滤、蒸发,
NaCl和KNO3方法为结晶,步骤:溶解、冷却结晶。(冷却热饱和溶液法)
对溶解度受温度变化不大的物质用蒸发溶剂的方法来得到晶体(如NaCl)。
对溶解度受温度变化比较大的物质用冷却热的饱和溶液的方法来得到晶体(如KNO3、CuSO4)
冷却饱和CuSO4溶液析出晶体的化学式为CuSO4?5H2O。
4、碘酒中溶质是碘,溶剂是酒精。盐酸中溶质是HCl,石灰水中溶质为Ca(OH)2,食盐水中溶质为NaCl,氧化钙溶于水溶质为Ca(OH)2,三氧化硫溶于水溶质为H2SO4,胆矾CuSO4?5H2O溶于水溶质为CuSO4,医用酒精中溶质为C2H5OH。
(组成与结构)
1、分子是保持物质化学性质的最小粒子(原子、离子也能保持物质的化学性质)。原子是化学变化中的最小粒子。
例如:保持氯气化学性质的最小粒子是D(氯分子)(A、Cl B、Cl- C、2Cl D、Cl2)。保持CO2化学性质的最小粒子是CO2分子;保持水银的化学性质的最小粒子是汞原子。在电解水这一变化中的最小粒子是氢原子和氧原子。
原子中:核电荷数(带正电)=质子数=核外电子数
相对原子质量=质子数+中子数
原子是由原子核和核外电子构成的,原子核是由质子和中子构成的,构成原子的三种粒子是:质子(正电)、中子(不带电)、电子(带负电)。一切原子都有质子、中子和电子吗?(错!一般的氢原子无中子)。
某原子的相对原子质量=某原子的质量/C原子质量的1/12。相对原子质量的单位是“1”,它是一个比值。相对分子质量的单位是“1”。
由于原子核所带电量和核外电子的电量相等,电性相反,因此整个原子不显电性(即电中性)。
2、①由同种元素组成的纯净物叫单质(由一种元素组成的物质不一定是单质,也可能是混合物,但一定不可能是化合物。)
②由一种分子构成的物质一定是纯净物,纯净物不一定是由一种分子构成的。
③由不同种元素组成的纯净物一定是化合物;由不同种元素组成的物质不一定是化合物,但化合物一定是由不同种元素组成的。
纯净物与混合物的区别是物质的种类不同。
单质和化合物的区别是元素的种类不同。
④由两种元素组成的,其中一种是氧元素的化合物叫氧化物。氧化物一定是含氧化合物,但含氧化合物不一定是氧化物。
⑤元素符号的意义:表示一种元素,表示这种元素的一个原子。
⑥化学式的意义:表示一种物质,表示这种物质的元素组成,表示这种物质的一个分子,表示这种物质的一个分子的原子构成。
⑦物质是由分子、原子、离子构成的。
由原子直接构成的:金属单质、稀有气体、硅和碳。
由分子直接构成的:非金属气体单质如H2、O2、N2、Cl2等、共价化合物、一些固态非金属单质如磷、硫等。分子又是由原子构成的。
共价化合物是由非金属与非金属(或原子团)组成,如CO2、H2O、SO3、HCl、H2SO4。
由离子直接构成的:离子化合物(金属与非金属或原子团)如NaCl、CaCl2、MgS、NaF、ZnSO4。构成氯酸钾的微粒是K+、ClO3-。
3、决定元素的种类是核电荷数(或质子数),(即一种元素和另一种元素的本质区别是质子数不同或者核电荷数不同);决定元素的化学性质的是最外层电子数。
同种元素具有相同的核电荷数,如Fe、Fe2+、Fe3+因核电荷数相同,都称为铁元素,但最外层电子数不同,所以他们的化学性质也不同。
核电荷数相同的粒子不一定是同种元素,如Ne、HF、H2O、NH3、CH4。
已知RO32-有32个电子,则R的质子数为:R+8×3+2=32
(质量守恒定律)
1、在一切化学反应中,反应前后①原子的种类没有改变,②原子的数目没有增减,③原子的质量也没有变化,所以反应前后各物质的质量总和相等。
小结:在化学反应中:
一定不变的是:①各物质的质量总和②元素的种类元素的质量④原子的种类⑤原子的数目⑥原子的质量;
一定改变的是:①物质的种类②分子的种类;
可能改变的是分子的数目。
书写化学方程式应遵守的两个原则:一是必须以客观事实为基础,二是要遵守质量守恒定律,“等号”表示两边各原子的数目必须相等。
(酸、碱、盐)
1、固体NaCl、KNO3、NaOH、Mg(NO3)2等不能导电,其水溶液能导电,所以酸碱盐溶液能导电,但有机物溶液不导电。
2、氯酸钾溶液中是否含有自由移动的氯离子?(没有,只含有自由移动的氯酸根离子)
3、能导电的溶液中,所有阳离子所带的正电荷总数等于阴离子所带的负电荷总数,所以整个溶液不显电性。
例如某溶液中Na+∶Mg2+∶Cl-=3∶2∶5,如Na+为3n个,求SO42-的个数,(此类题要会)解:3n+2×2n=5n+2x,则x=
4、盐中一定含有金属离子或金属元素(×) 碱中一定含有金属元素(×)
化合物中一定含有非金属元素(√) 碱中一定含有氢氧元素(√)
酸中一定含有氢元素(√) 有机物中一定含有碳元素(√)
5、使紫色的石蕊试液变红的溶液不一定是酸溶液,但一定是酸性溶液;(如NaHSO4溶液是盐溶液,但溶液显酸性)
使紫色的石蕊试液变蓝的溶液不一定是碱溶液,但一定是碱性溶液。(如Na2CO3溶液是盐溶液,但溶液显碱性)
6、X-和Cl-具有相似的化学性质,说出HX的化学性质(酸的通性)
i. 与酸碱指示剂作用,紫色石蕊遇HX变红色,无色酚酞不变色。
ii. 与金属反应生成盐和氢气(条件:①在活动性顺序表中,只有排在H前面的金属才能置换出酸中的氢;②酸除了HNO3和浓H2SO4,氧化性强,与金属反应时,不生成氢气而生成水,H2CO3酸性太弱)
iii. 与金属氧化物反应生成盐和水(一定反应)
iv. 与碱反应生成盐和水(一定反应)
v. 与某些盐反应生成另一种酸和另一种盐(条件:生成物有沉淀或气体)
7、溶液的酸碱度常用pH来表示,pH=7时溶液呈中性,pH<7时呈酸性,pH>7时呈碱性。
PH=0时呈酸性,pH越小,酸性越强,pH越大,碱性越强。
蒸馏水的pH=7(雨水的pH<7显弱酸性),SO3溶于水,溶液pH<7,CO2溶于水,溶液pH<7;pH升高可加碱(可溶性碱)或水,pH降低可加酸或水。PH=3和pH=4混合溶液pH<7,测定pH的最简单的方法是使用pH试纸,测定时,用玻璃棒把待测溶液滴在pH试纸上,然后把试纸显示的颜色跟标准比色卡对照,便可知溶液的pH。pH数值是整数。
8、碱的通性
由于碱在水溶液里都能电离而生成OH-离子,所以它们有一些相似的化学性质。
(1) 碱溶液能跟酸碱指示剂起反应。(条件:碱必须可溶)紫色的石蕊试液遇碱变蓝色,无色酚酞试液遇碱变红色。例如Fe(OH)3中滴入紫色的石蕊试液,石蕊不变色。
(2) 碱能跟多数非金属氧化物起反应,生成盐和水。条件:碱必须可溶,例如Cu(OH)2+CO2不反应
(3) 碱能跟酸起中和反应,生成盐和水。酸和碱作用生成盐和水的反应叫做中和反应。
(4) 碱能跟某些盐起反应,生成另一种盐和另一种碱,条件:反应物均可溶,生成物有沉淀。
9、盐的性质
①跟某些金属反应生成另一种金属和另一种盐,条件:①盐可溶②在活动性顺序表中排在前面的金属才能把排在后面的金属从它的盐溶液中置换出来。(K、Ca、Na太活泼,不和盐置换)
②盐与酸反应 (与前面相同)
③盐与碱反应 (与前面相同)
④盐与盐反应 条件:反应物均溶,且生成物中有沉淀。
10、氧化物
① 定义:凡与酸反应生成盐和水的氧化物叫碱性氧化物,金属氧化 物大多数是碱性氧化物。(除Al2O3、ZnO外)
凡与碱反应生成盐和水的氧化物叫酸性氧化物,非金属氧化物大多数是酸性氧化物。(除CO、H2O外)
② 性质 与水反应(碱可溶)
碱性氧化物大多数不溶于水中,除了Na2O、K2O、BaO、CaO外,Na2O+H2O=2NaOH,CuO+H2O=不反应。
酸性氧化物大多数溶于水(除了SiO2外)SO3+H2O=H2SO4,CO2+H2O=H2CO3,SiO2+H2O=不反应。
11、物质的检验
酸液(H+):只能用紫色石蕊试液 碱液(OH-):紫色石蕊试液和无色酚酞均可。
盐酸和Cl-:用AgNO3溶液和稀HNO3 硫酸和SO42-:用BaCl2溶液和稀HNO3
区别Cl-和SO42-:只能用BaCl2溶液不能用AgNO3溶液 CO32-:用盐酸和石灰水
铵盐(NH4+):用浓NaOH溶液(微热)产生使湿润的红色石蕊试纸变蓝的气体。
12、物质的俗名或主要成分、化学式:
氢氯酸(俗名为盐酸)HCl 氯酸HClO3 氢硫酸H2S 硫酸H2SO4 硝酸HNO3 磷酸H3PO4 氧化钙CaO (生石灰)氢氧化钙Ca(OH)2 (熟石灰 消石灰)Ca(OH)2水溶液俗名石灰水 石灰石的主要成分是:CaCO3 磷酸氢二钠Na2HPO4 氢氧化钠 NaOH(火碱、烧碱、苛性钠) 氯化钠NaCl(食盐) 粗盐中含有MgCl2、CaCl2杂质而易潮解 尿素CO(NH2)2
工业盐中含有亚硝酸钠NaNO2 亚硫酸钠Na2SO3 碳酸钠Na2CO3(纯碱)(水溶液呈碱性,但不是碱)纯碱晶体Na2CO3?10H2O 波尔多液CuSO4和Ca(OH)2 硫酸铜晶体CuSO4?5H2O (蓝矾、胆矾)磷酸二氢钙Ca(H2PO4)2 碳酸氢钠NaHCO3 硫酸氢钠NaHSO4 氨水NH3?H2O(属于碱类)过磷酸钙是混合物
有关物质的颜色:
Fe(OH)3红褐色沉淀 Fe2O3红(棕)色 Fe2(SO4)3、FeCl3 、Fe(NO3)3溶液(即Fe3+的溶液)**FeSO4 、FeCl2 、Fe(NO3)2、(即Fe2+)浅绿色 Fe块状是白色的,粉末状是黑色,不纯的是黑色
Cu(OH)2蓝色沉淀 CuO黑色 CuCl2、 Cu(NO3)2、 CuSO4溶液(即Cu2+的溶液)蓝色无水CuSO4是白色 CuSO4?5H2O是蓝色 Cu(紫)红色
BaSO4、AgCl是不溶于 HNO3的白色沉淀
CaCO3 BaCO3是溶于HNO3 的白色沉淀
KClO3白色 KCl白色 KMnO4紫黑色 MnO2黑色 Cu2(OH)2CO3绿色
13、用途、性质
⑴浓HCl、浓HNO3具有挥发性,放在空气中质量减轻。
⑵浓H2SO4:吸水性,放在空气中质量增重。使纸张或皮肤变黑是硫酸的脱水性。
⑶粗盐(因含有CaCl2、MgCl2杂质而潮解),放在空气中质量增重。
⑷NaOH固体(白色)能吸水而潮解,又能与空气中的CO2反应而变质,所以NaOH必须密封保存。放在空气中质量增加且变质。NaOH中含有的杂质是Na2CO3。
⑸碳酸钠晶体Na2CO3?10H2O,由于在常温下失去结晶水(叫风化),放在空气中质量减轻且变质。
⑹无水CuSO4:能吸水(检验水的存在)。
⑺铁、白磷放在空气中质量增加。
⑻生石灰放在空气中变质:CaO+H2O=Ca(OH)2 Ca(OH)2+CO2=CaCO3↓+H2O
⑼需密封保存:浓HCl、浓HNO3、浓H2SO4、NaOH、CaO、Ca(OH)2、铁、白磷、纯碱晶体。
⑽稀HCl、H2SO4用于除锈。
⑾ NaOH不能用于治疗胃酸(HCl)过多,应用Al(OH)3 Al(OH)3+HCl
⑿ 熟石灰用于改良酸性土壤,农业上农药波尔多液[CuSO4和Ca(OH)2]
⒀ 粗盐中含有杂质是CaCl2、MgCl2 工业用盐中含有杂质是NaNO2(亚硝酸钠)
工业酒精中含有杂质是CH3OH NaOH中含有杂质是Na2CO3
CaO中含有杂质是CaCO3
⒁ 检验Cl-:AgNO3、HNO3溶液 检验SO42-:BaCl2、HNO3溶液
区别HCl、H2SO4:用BaCl2溶液
⒂ 改良酸性土壤用Ca(OH)2, 制取NaOH用:Ca(OH)2+ Na2CO3—
制取Ca(OH)2用:CaO+H2O—
波尔多液不能使用铁制容器是因为:CuSO4+Fe—
不发生复分解反应的是:KNO3、NaCl
14、制碱
(1)可溶性碱 ①碱性氧化物溶于水 CaO+H2O= Ca(OH)2
②碱和盐反应 Ca(OH)2+ Na2CO3=CaCO3↓+2NaOH
(2)不溶性碱 碱和盐反应 2Cu+O2△2CuO,CuO+2HCl=CuCl2+H2O,
CuCl2+2NaOH= Cu(OH)2↓+2NaCl
不溶性碱可受热分解:Cu(OH)2△CuO+ H2O
制金属铜:两种方法①还原剂还原CuO②金属与盐反应如:CuSO4+Fe
制盐例如MgCl2:①Mg+HCl ②MgO+HCl ③Mg(OH)2+HCl
(实验部分)
1:常用的仪器(仪器名称不能写错别字)
A:不能加热:量筒、集气瓶、漏斗、温度计、滴瓶、表面皿、广口瓶、细口瓶等
B:能直接加热:试管、蒸发皿、坩埚、燃烧匙
C:间接加热:烧杯、烧瓶、锥形瓶
(1)试管 常用做①少量试剂的反应容器②也可用做收集少量气体的容器③或用于装置成小型气体的发生器
(2)烧杯 主要用于①溶解固体物质、配制溶液,以及溶液的稀释、浓缩②也可用做较大量的物质间的反应
(3)烧瓶----有圆底烧瓶,平底烧瓶
①常用做较大量的液体间的反应②也可用做装置气体发生器
(4)锥形瓶 常用于①加热液体,②也可用于装置气体发生器和洗瓶器③也可用于滴定中的受滴容器。
(5)蒸发皿 通常用于溶液的浓缩或蒸干。
(6)胶头滴管 用于移取和滴加少量液体。
注意: ①使用时胶头在上,管口在下(防止液体试剂进入胶头而使胶头受腐蚀或将胶头里的杂质带进试液 ②滴管管口不能伸入受滴容器(防止滴管沾上其他试剂) ③用过后应立即洗涤干净并插在洁净的试管内,未经洗涤的滴管严禁吸取别的试剂 ④滴瓶上的滴管必须与滴瓶配套使用
(7)量筒 用于量取一定量体积液体的仪器。
不能①在量筒内稀释或配制溶液,决不能对量筒加热 。
也不能②在量筒里进行化学反应
注意: 在量液体时,要根据所量的体积来选择大小恰当的量筒(否则会造成较大的误差),读数时应将量筒垂直平稳放在桌面上,并使量筒的刻度与量筒内的液体凹液面的最低点保持在同一水平面。
(8)托盘天平 是一种称量仪器,一般精确到0.1克。注意:称量物放在左盘,砝码按由大到小的顺序放在右盘,取用砝码要用镊子,不能直接用手,天平不能称量热的物体, 被称物体不能直接放在托盘上,要在两边先放上等质量的纸, 易潮解的药品或有腐蚀性的药品(如氢氧化钠固体)必须放在玻璃器皿中称量。
(9)集 气 瓶 ①用于收集或贮存少量的气体 ②也可用于进行某些物质和气体的反应。
(瓶口是磨毛的)
(10)广 口 瓶 (内壁是磨毛的) 常用于盛放固体试剂,也可用做洗气瓶
(11)细 口 瓶 用于盛放液体试剂 ,棕色的细口瓶用于盛装需要避光保存的物质,存放碱溶液时试剂瓶应用橡皮塞,不能用玻璃塞。
(12)漏 斗 用于向细口容器内注入液体或用于过滤装置。
(13)长颈漏斗 用于向反应容器内注入液体,若用来制取气体,则长颈漏斗的下端管口要插入液面以下,形成“液封”,(防止气体从长颈斗中逸出)
(14)分液漏斗 主要用于分离两种互不相溶且密度不同的液体,也可用于向反应容器中滴加液体,可控制液体的用量
(15)试管夹 用于夹持试管,给试管加热,使用时从试管的底部往上套,夹在试管的中上部。
(16)铁架台 用于固定和支持多种仪器, 常用于加热、过滤等操作。
(17)酒精灯 ①使用前先检查灯心,绝对禁止向燃着的酒精灯里添加酒精
②也不可用燃着的酒精灯去点燃另一酒精灯(以免失火)
③酒精灯的外焰最高, 应在外焰部分加热 先预热后集中加热。
④要防止灯心与热的玻璃器皿接触(以防玻璃器皿受损)
⑤实验结束时,应用灯帽盖灭(以免灯内酒精挥发而使灯心留有过多的水分,不仅浪费酒精而且不易点燃),决不能用嘴吹灭(否则可能引起灯内酒精燃烧,发生危险)
⑥万一酒精在桌上燃烧,应立即用湿抹布扑盖。
(18)玻璃棒 用做搅拌(加速溶解)转移如PH的测定等。
(19)燃烧匙
(20)温度计 刚用过的高温温度计不可立即用冷水冲洗。
(21)药匙 用于取用粉末或小粒状的固体药品,?
有关镀锡技术的配方资料
我国古代铜镜的几种常见缺陷、缺损,以及古人的部分补救措施。在这缺陷缺损中,组织疏松是由金属自身属性决定的,是不可避免的;既不能消除,也不能减少,只能使之移动位置;稍有疏忽,它便会一磨即现,虽细如针尖,却密密麻麻,乌乌蒙蒙。刮削、研磨道纹应可消除,但由于古代的刮削研磨条件较差,实际上它又是不可避免、不可以消除的。从传统工艺调查来看,一些小型工厂即许利用了现代机械加工手段,加工道纹依然是经常可见;古时更是这样。所以,组织疏松和刮磨道痕实际上普遍地存在于所有的镜中,正常生产之镜也不得例外。气泡、砂眼、发气残痕、夹杂也应当是可以避免的,但因受多种复杂工艺因素的影响,实际上也很难完全消除;夹杂和发气残痕在古镜表面上都经常可见。为了消除或减少这些缺陷和缺损对铜镜映照效果的影响,人们取了许多补救措施,上述部分缺陷和缺损的修整处理仅仅是第一步,之后皆需进行一道表面镀锡。组织疏松、细小夹杂、轻微发气,一般不作上述第一步修整。
我们曾对一些带有气泡、砂眼、断裂遗痕的试样进行过许多观察和分析。结果发现,该处的表面颜色和光泽,与同一枚镜的其他部分基本上是一致的;其表面成份,则与颜色相当的同一枚镜,或不同的镜,都是基本一致的。如鄂州半圆方枚神兽镜E30,我们在试样断口附近的正面作过多处取样分析,其中一处的成份为:铜7.713%、锡51.857%、铅12.513%、铁5.571%、硅6.410、铝3.385%、磷2.414%、银4.493%(灰绿而泛白处)。另一处的成份为:铜12.906、锡61.164%、铅11.423%、铁6.149%、硅4.954%、硅2.133%,银1.268%。这两处成份大体一致,与一般的绿漆古镜表面皆属同一成份范围。鄂州直列重铭神兽镜E14各部的表面成份,不管补块部分还是非补块部分,都基本一致。其正表面成份为:铜13.39%、锡69.98%、铅6.284%、铁0.603%、硅5.681%、铝2.521%、银1.536%。这表明,缺陷处的表面处理工艺,与铜镜正常部位的表面处理工艺基本一致,都是使用粉涂锡汞齐的方式来实现表面镀锡的。一旦外镀,所有缺陷、缺损,所有不光洁的、粗糙的表面,都将被洁白光净的镀锡层掩盖,整个镜面便光洁如一起来。《淮南子·修务训》云:“明镜之始下型,朦然未见形容,及其粉以玄锡,摩以白旃,鬓眉微毫可得而察。”玄,即黑,玄锡即黑锡,即是以汞处理过了的、颜色灰黑之“锡”,也即是锡汞齐④。这段文字是对铜镜表面处理工艺最为确切而简明的写照。对四神镜E3、直铭重列神兽镜E14等而言,其缺陷修补步骤是:(1)用软质合金填充气孔和砂眼;(2)表面镀锡并打光。对半圆方枚神兽镜E30言,其修补工艺程序当是:(1)清理破镜的断口和镜面。(2)用某粘结剂将破镜粘合,并在镜面一侧的断裂处粘上一层强度较高的白纸。(3)整个镜面均匀镀锡。最后,破镜重圆。
另外一面还有一些专利及参考资料 记住 只是一部分 更多的你得到专利网站及下面网址上查:
镀锡 发明专利(33条)
记录号 申请号 专利名称
1 86100716 以软带包装的电子元件导线之自动镀锡设备
2 88108443.3 电子元件的镀锡方法和装置
3 88105472.0 铜或铜合金室温镀锡工艺
4 89104464.7 一种光亮镀锡-锌合金电镀溶液
5 91110903.X 锌基合金镀锡轴瓦生产工艺
6 93104326.3 清洗镀锡钢板料的组合物和方法
7 94102842.9 一种酸性镀锡的方法
8 94103333.3 镀锡液的回收再生方法
9 95111809.9 一种镀锡铜线废料和锡铝废渣的再生工艺及用装置
10 95116356.6 调整镀锡丝拉伸强度的方法
11 95112787.X 镀锡钢板电镀用锡粒的制备方法
12 95116357.4 镀锡丝表面处理溶液及涂覆该溶液的装置
13 95110442.X 铜线镀锡工艺
14 961079.5 用含水蒸汽气氛在焊接或镀锡前干软制金属表面的方法
15 109800.X 波动钎焊或镀锡的方法和机器
16 193376.6 镀锡的方法和最佳电流密度范围宽的镀锡液
17 00118740.6 用合金锡焊或镀锡时封闭室内气氛的分析系统
18 00107220.X 工作物热浸镀锡的加工方法
19 00107221.8 冲板式组合件的板片接合缝的热浸镀锡填补方法
20 00806441.5 耐蚀性好的镀锡系或镀铝系表面处理钢材
21 01105413.1 从镀锡、浸锡和焊锡的金属废料回收锡的方法及其装置
22 02105649.8 镀锡钢板
23 02115956.4 镀锡板酸浸时滞值的电化学测定装置及方法
24 00815462.7 铜或铜合金非电镀镀锡的方法
25 01126771.2 镀锡拉丝模镶套的生产工艺
26 02105651.X 镀锡
27 01806287.3 表面处理镀锡钢板及化成处理液
28 02120377.6 镀锡用组合物及镀锡方法
29 03138461.7 镀锡方法
30 02157959.8 无铅合金镀锡铜线
31 03164817.7 镀锡的方法
32 01823668.5 电解镀锡溶液和用于电镀的方法
33 200410044517.7 改良镀锡方法
镀锡文献280篇
镀锡
1 原板内应力对镀锡板耐蚀性的影响 黄兴桥 李宁... 上海金属-2005-1
2 酸性光亮镀锡镍合金镀液中镍的快速测定 罗序燕 材料保护-2005-1
3 铬酸盐钝化膜对低锡量镀锡板性能的影响 柳长福 涂元强... 材料保护-2004-12
4 镀锡——堵漏的重要手段 侯荣阶 宋勇... 材料保护-2004-12
5 镀锡铜线表面锡的回收 雷勇强 喻阳海... 有色金属:冶炼部分-2004-6
6 2004-10月份镀锡板分国别(地区)进口情况表 无 中国钢铁业-2004-12
7 电镀锡机组软熔导电辊粘锡失效模拟研究 符寒光 上海金属-2004-6
8 原板酸洗失重性能对镀锡板耐蚀性的影响 黄兴桥 韩家军... 电镀与环保-2004-4
9 2004-9月份镀锡板分国别(地区)进口情况表 无 中国钢铁业-2004-11
10 湿膜镀锡板的圈状渗镀问题 苑玉明 印制电路资讯-2004-5
11 镀锡板生产线 M.Righini M.Bianco 钢铁-2004-9
12 电镀锡工艺产生露铜的原因分析及解决方法 范德发 电线电缆-2004-5
13 镀锡电解液 无 电镀与精饰-2004-5
14 2004-7月份镀锡板分国别(地区)进口情况表 无 中国钢铁业-2004-9
15 2004-8月份镀锡板分国别(地区)进口情况表 无 中国钢铁业-2004-10
16 镀锡板性能影响因素的分析 卢笙 宝钢技术-2004-5
17 超声电镀锡铋合金研究 陈华茂 吴华强 表面技术-2004-5
18 2004-6月份镀锡板分国别(地区)进口情况表 无 中国钢铁业-2004-8
19 高速镀锡电解液中油污的形成及其防治 宋强[1] 蔡兰坤[1]... 材料保护-2004-10
20 电镀锡及其合金电解液 无 电镀与精饰-2004-4
21 电镀锡及锡合金光亮剂的制备方法 无 电镀与精饰-2004-4
22 镀锡板表面黑点缺陷分析 季思凯 理化检验:物理分册-2004-8
23 原板结晶取向对镀锡板耐蚀性的影响 黄兴桥 李宁... 材料保护-2004-9
24 宝钢1420电镀锡机组中央段张力控制分析及改进 李东江 黄正芳... 宝钢技术-2004-3
25 海字卤素法电镀锡板生产技术开发研究——2003-中国有色金属工业科学技术一等奖 无 有色冶金设计与研究-2004-2
26 镀锡钢板耐蚀性与恒电流阳极溶解电位-时间曲线的关系 王焜[1] 钱钢[2]... 金属学报-2004-7
27 电镀锡及锡-铅合金电解液 覃奇贤 电镀与精饰-2004-3
28 软熔条件对镀锡板合金层组织及其耐蚀性的影响 黄久贵 李宁... 上海金属-2004-3
29 日本试销超薄镀锡板啤酒罐反响强烈 牟发章 包装与食品机械-2004-2
30 无污染适用于焊接的HKFe—Sn铁(或铜)内电解镀锡 无 表面技术-2004-2
31 铈盐对电镀锡参数和性能的影响 于锦 郭春光... 表面技术-2004-2
32 新型光亮镀锡铅钴合金镀液中微量钴的快速测定 罗序燕 钟洪鸣 表面技术-2004-2
33 印制板的表面终饰工艺系列讲座——第三讲 TI-1新型印制板用置换镀锡工艺 方景礼 电镀与涂饰-2004-2
34 光亮硫酸盐镀锡工艺及生产实践 何祚明 曾领才... 电镀与涂饰-2004-2
35 高速镀锡液中油污的形成机理 宋强[1] 蔡兰坤[1]... 电镀与环保-2004-2
36 库仑-称重法及其测量电镀锡板镀层厚度的研究 董秀文[1] 李岩[1]... 电化学-2004-1
37 镀锡板无铬钝化 无 材料保护-2004-3
38 新型酸性光亮镀锡铜合金液中微量铜的快速测定 罗序燕 材料保护-2004-3
39 宝钢镀锡板翘曲原因分析与对策 何建锋 宝钢技术-2004-1
40 镀锡板基板结晶取向与合金层形貌及ATC值的关系 黄久贵 李宁... 上海金属-2004-2
41 聚乙二醇苯基辛基醚对甲磺酸镀锡层织构的影响 杜小光[1] 牛振江[2]... 电镀与精饰-2004-2
42 印制板的表面终饰工艺系列讲座:第二讲超薄型超高密度挠性印制板的置换镀锡工艺 方景礼 电镀与涂饰-2004-1
43 镀锡铜线脱锡工艺 郎庆成 再生研究-2004-1
44 浅谈提高热镀锡细铜线质量的几个问题 买利伟 电线电缆-2004-1
45 SMD可焊性电镀锡及锡—铅合金 陆金龙 电镀与环保-2004-1
46 镀锡工艺参数对合金层形貌及耐蚀性的影响 黄久贵 李宁... 电镀与环保-2004-1
47 智能型镀锡量测量仪的研制 董秀文[1] 李岩[1]... 材料保护-2003-5
48 MR—TH57电镀锡薄钢板的研制与应用 涂元强 苏维嘉... 武钢技术-2003-3
49 薄钢板镀锡含铬废水处理 袁安政[1] 李肖雄[2] 电镀与环保-2003-6
50 焦磷酸盐电镀锡—锌合金 巢发荣 电镀与环保-2003-6
51 镀锡板耐蚀性研究及进展 黄久贵 李宁... 电镀与环保-2003-6
52 怎样防治和减少酸性镀锡液的混浊现象 罗耀宗 电镀与涂饰-2003-6
53 镀锡层重熔处理 郑瑞庭 电镀与涂饰-2003-4
54 宝钢电镀锡机组2#软熔导电辊粘锡失效模拟研究 戴明山 冶金设备-2003-5
55 原板夹杂引起的镀锡板表面缺陷分析 季思凯 王林 物理测试-2003-5
56 合金层白点的产生及其对镀锡板耐蚀性的影响 黄久贵[1] 李宁[1]... 中国有色金属学报-2003-5
57 镀锡板的无铬钝化 柳长福 涂元强... 武钢技术-2003-5
58 酸性光亮镀锡铈合金工艺 屈战民 材料保护-2003-9
59 极限规格电镀锡板折皱分析及对策 王劲 周耀 轧钢-2003-4
60 具有铜基中间镀层的镀锡层 无 电镀与精饰-2003-4
61 镀锡方法对无汞碱锰电池用铜钉的性能影响 黎学明[1] 刘飞[1]... 电池-2003-3
62 工艺因素对化学镀锡层成分的影响 徐瑞东 薛方勤... 新技术新工艺-2003-6
63 电镀锡薄钢板的镀后处理 戴杭杰 广东有色金属学报-2003-1
64 PCB的化学镀锡应用技术 张志祥 印制电路信息-2003-4
65 酸性镀锡液不稳定性研究 龙有前 肖鑫... 材料保护-2003-3
66 甲磺酸盐光亮镀锡铅合金工艺研究 王爱荣 荆瑞俊... 表面技术-2003-3
67 薄镀锡板用高性能冷轧油的开发和应用 曹长娥 材料保护-2003-3
68 用非自耗阳极进行镀锡作业 兰若 钢铁-2003-4
69 一种新的镀锡量测试设备 田伟 武钢技术-2003-2
70 得兴技术公司开发出镀锡新技术 陆岩 轧钢-2003-2
71 锌合金压铸件滚镀锡—钴合金 马忠信 电镀与精饰-2003-3
72 高速镀锡电解液 无 电镀与精饰-2003-3
73 镀锡钢带镀锡量的测定 邱月梅 金属制品-2003-2
74 酸性镀锡中过量硫酸根的去除 罗耀宗 电镀与涂饰-2003-2
76 钢带镀锡前表面清洗质量的改善 范宏义 材料保护-2003-4
77 过氧化氢法处理镀锡含氰废水 曹学增 陈爱英 常熟高专学报-2003-2
78 化学镀锡层孔隙率研究 徐瑞东 郭忠诚... 电镀与精饰-2003-2
79 改进的热浸镀锡工件夹制具 蔡振发 表面技术-2003-1
80 钢管内表面镀锡工艺探讨 罗耀宗 电镀与环保-2003-1
81 电镀锡合金电解液 覃奇贤 电镀与精饰-2003-1
82 由食用镀锡罐装淡奶引起食物中毒的样品分析 董桂芬 许计... 中国卫生检验杂志-2002-6
83 装饰性和功能性的电镀锡合金(下) 无 国际表面处理-2002-1
84 青-在行动——记宝钢股份有限公司冷轧厂镀锡分厂“青-安全示范岗”活动 刘燕 上海安全生产-2002-12
85 胎圈钢丝化镀锡青铜工艺研究 仝奎[1] 窦光聚[2] 金属制品-2002-6
86 用于印刷线路板的无氟无铅酸性镀锡 刘仁志 电子电路与贴装-2002-6
87 化学镀锡层成分与表面形貌及结构分析 徐瑞东 郭忠诚... 表面技术-2002-6
88 SS系列酸性光亮镀锡添加剂的研究 刘飞[1] 迟洪训[2] 电镀与环保-2002-6
89 电镀锡—锌合金的水溶液 无 电镀与涂饰-2002-5
90 电镀锡板表面抗划伤性的研究Ⅱ.软熔工艺对电镀锡板表面抗划伤性的影响 刘小兵[1] 王徐承[2]... 电镀与精饰-2002-6
91 化学镀锡—银合金 王丽丽 电镀与精饰-2002-6
92 酸性镀锡溶液除铁杂质方法 谭奇贤 电镀与精饰-2002-6
93 化学镀锡工艺条件的优化 王军丽 徐瑞东... 电镀与环保-2002-5
94 铜基上化学镀锡工艺研究 陈春成 电镀与精饰-2002-5
95 电镀锡板表面抗划伤性的研究 Ⅰ.关于测试方法 刘小兵[1] 王徐承[2]... 电镀与精饰-2002-5
96 酸性光亮镀锡工艺的研究 欧阳双 谭强 电镀与环保-2002-4
一炼钢镀锡板连铸板坯夹杂物分布试验研究 王军文[1] 唐海波[2]... 宝钢技术-2002-4
98 罩式炉退火T4级上限硬度镀锡原板生产工艺优化 吴迪[1] 周正元[2]... 钢铁-2002-7
99 罐装食品用电镀锡板的耐蚀性及其试验方法 李岩[1] 刘晓鹏[2]... 材料保护-2002-8
100 大件镀锡故障的排除 陈怀超 材料保护-2002-8
101 镀锡青铜回火胎圈钢丝生产线 滕留芝 轮胎工业-2002-8
102 大件镀锡故障的排除 陈怀超 电镀与精饰-2002-4
103 用催化剂的化学镀锡新工艺的研究 梅天庆[1] 冯辉[2] 南京航空航天大学学报-2002-3
104 电镀锡渣制备氯化亚锡和锡酸钠 曹学增 陈爱英 应用化工-2002-3
105 化镀锡青铜回火胎圈钢丝生产工艺技术 宋为 王宝玉 金属制品-2002-2
106 铝铸件电镀锡的研究 邓小民 电镀与环保-2002-3
107 化学镀锡层可焊性研究 徐瑞东 郭忠诚... 电子工艺技术-2002-3
108 旋耐德Quantum自动化平台在武钢电镀锡线的应用 谈靖 张旭东 国内外机电一体化技术-2002-2
109 离子色谱法测定电镀锡溶液中的SO4^2— 朱子平 化学分析计量-2002-2
110 微电子管电镀锡、锡—铅技术 陆金龙 电镀与精饰-2002-2
111 滚镀锡—钴—锌代铬工艺在小五金件的应用 胡卓明 电镀与精饰-2002-1
112 印制电路故障排除手册选登电镀锡铅合金镀层工艺 源明 印制电路与贴装-2002-1
113 国内镀锡板生产企业应提高竞争力 无 中小企业信息-2001-4
114 世界镀锡板工业的回顾与展望 罗德先 世界有色金属-2001-9
115 未来5-镀锡板供求展望 无 重庆经济信息-2001-16
116 一种多功能镀锡添加剂镀液性能的研究 陈华茂 吴华强 安徽师范大学学报:自然科学版-2001-3
117 铝排局部刷镀锡溶液及工艺的研究 欧阳晟 夏光明 电刷镀技术-2001-4
118 电镀锡合金 蔡积庆 电镀与环保-2001-5
119 装饰性和功能性的电镀锡合金(上) 无 国际表面处理-2001-6
120 镀锡薄板厂工业废水处理 曹益宁 有色冶金节能-2001-3
121 镀锡防锈材料的改进 程喜[1] 张惠萍[2] 湖北造纸-2001-4
122 新型酸性镀锡光亮剂的表征及其性能 罗序燕[1] 罗国添[2]... 材料保护-2001-10
123 铜基上化学镀锡新工艺初探 徐瑞东 郭忠诚... 材料保护-2001-10
124 甲磺酸电镀锡铅合金工艺研究 池建明[1] 康京冬[2] 材料保护-2001-10
125 化学镀锡层结构及性能研究 徐瑞东 郭忠诚... 电镀与涂饰-2001-5
126 稀土催化剂抗酸性镀锡液氧化变质的研究 肖友军 电镀与涂饰-2001-4
127 铜基上化学镀锡新工艺初探 徐瑞东[1] 郭忠诚[2]... 电镀与涂饰-2001-4
128 酸性光亮镀锡 赵复荣 电镀与涂饰-2001-4
129 镀锡电解液的再生 覃奇贤 电镀与精饰-2001-6
130 从镀锡泥渣中回收金属锡 覃奇贤 电镀与精饰-2001-4
131 高稳定性酸性光亮镀锡工艺研究 肖鑫 龙有前... 腐蚀与防护-2001-9
132 酸性光亮镀锡 和海燕 赵复荣 机械管理开发-2001-4
133 用于PWB的高分散能力光亮酸性镀锡 刘仁志 印制电路信息-2001-11
134 黑瓷封装IC外引线镀锡后连锡短路的故障处理 杨建功 吴彩霞 电镀与涂饰-2001-5
135 D—T52冷轧电镀锡薄钢板的研制及应用 涂元强 苏维嘉.
。。。。。。
[免责声明]本文来源于网络,不代表本站立场,如转载内容涉及版权等问题,请联系邮箱:83115484@qq.com,我们会予以删除相关文章,保证您的权利。